Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Química ClínicaDiagnóstico MolecularHematologíaInmunologíaMicrobiología
TecnologíaIndustria
Eventos
Webinars

- Espectroscopia Raman portátil ofrece diagnóstico rentable de enfermedad renal en POC
- Nanopartículas de oro mejoran precisión del diagnóstico de cáncer ovárico
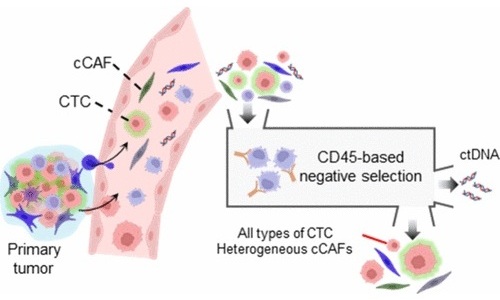
- Tecnología de aislamiento celular simultáneo mejora precisión del diagnóstico del cáncer
- Sencilla prueba capilar no invasiva podría acelerar diagnóstico de ELA
- Prueba de saliva detecta niveles elevados de ácido úrico sin necesidad de extraer sangre
- Pruebas genómicas podrían reducir biopsias de ganglios linfáticos en pacientes con melanoma
- Análisis de orina podría reemplazar dolorosas biopsias renales para pacientes con lupus
- Análisis de sangre guían inmunoterapia postquirúrgica para cáncer de vejiga músculo-invasivo
- Mutaciones del ADN mitocondrial derivadas de factores de estrés renal podrían predecir deterioro del órgano
- Análisis sanguíneo podría predecir resultados de cirugía bariátrica en adolescentes
- Pruebas viscoelásticas podrían mejorar tratamiento de hemorragia materna
- Modelo mide exposición a radiación en sangre para tratamientos precisos contra cáncer
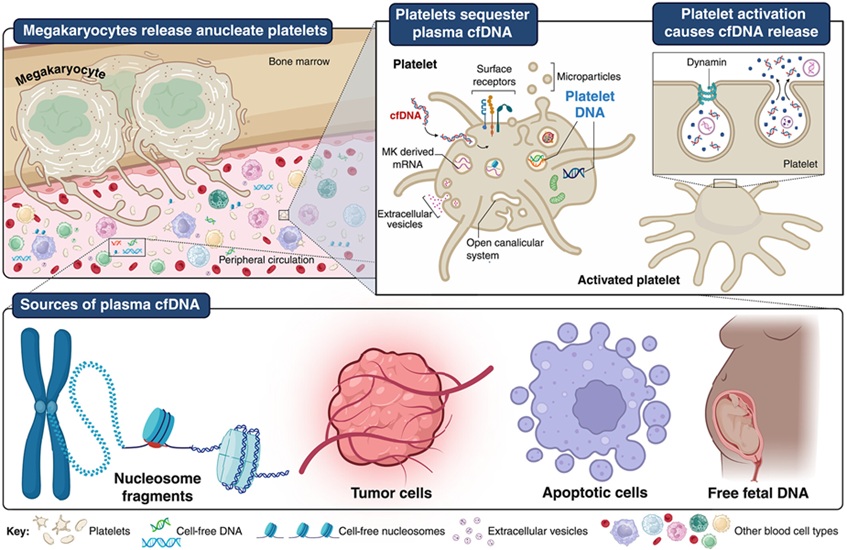
- Las plaquetas podrían mejorar detección temprana y mínimamente invasiva del cáncer
- Dispositivo portátil desechable obtiene plasma rico en plaquetas sin equipos complejos
- Prueba de cartucho desechable ofrece resultados de hemograma rápidos y precisos
- Genes característicos predicen expansión de células T en inmunoterapia
- Diagnóstico por microscopio molecular evalúa rechazo del trasplante de pulmón
- Análisis sanguíneo detecta resistencia al tratamiento en cáncer ovárico seroso de alto grado
- Sonda luminiscente mide actividad de células inmunitarias en tiempo real
- Firmas de células inmunitarias en sangre guían tratamiento para pacientes graves
- Dispositivo de diagnóstico rápido de sepsis para atención crítica personalizada a pacientes de UCI
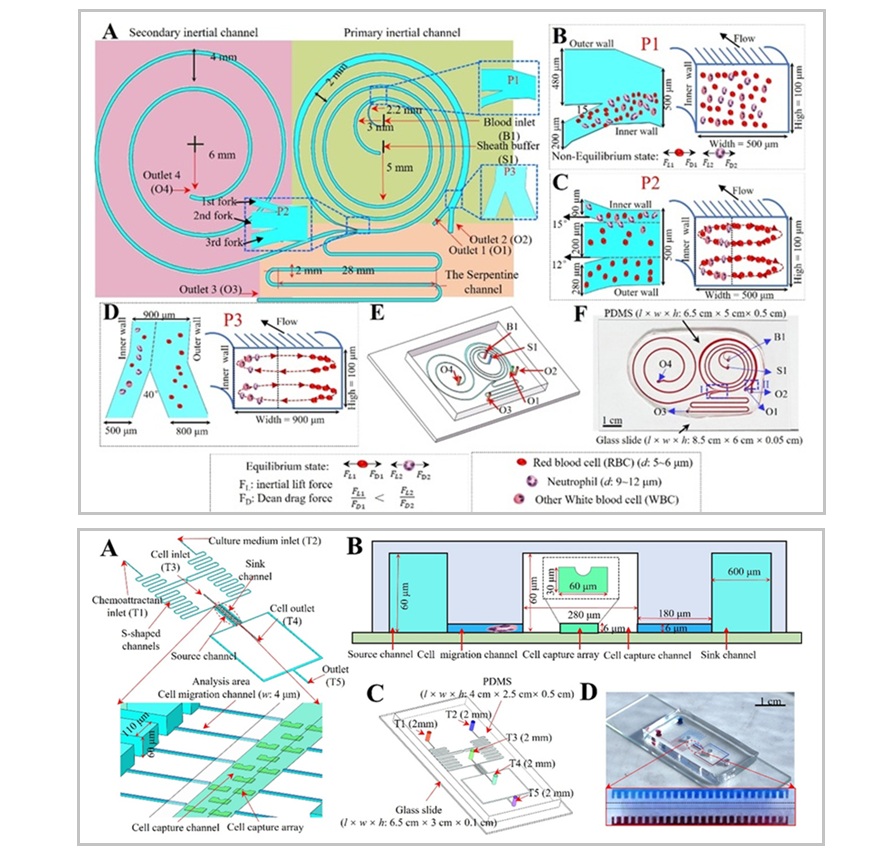
- Plataforma microfluídica evalúa función de neutrófilos en pacientes con sepsis
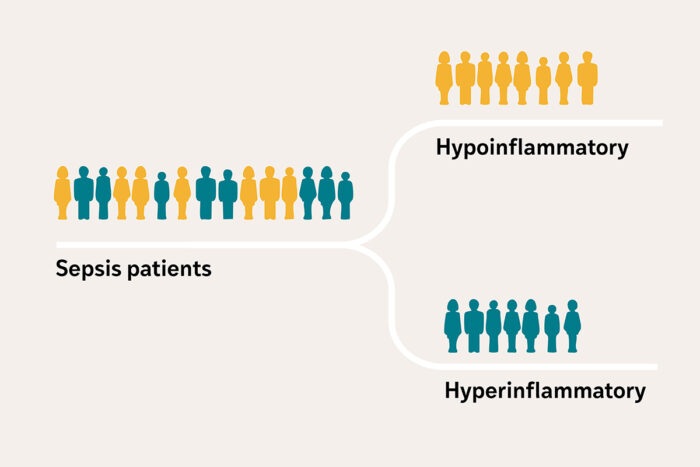
- Nuevo método diagnóstico confirma sepsis de forma más temprana
- Nuevos marcadores podrían predecir riesgo de infección grave por clamidia
- Espectroscopia portátil detecta de forma rápida y no invasiva bacterias en fluido vaginal
- Plataforma GPU integrada permite análisis rápido de sangre para diagnósticos en POC
- Prueba de biosensor viral detecta simultáneamente hepatitis y VIH
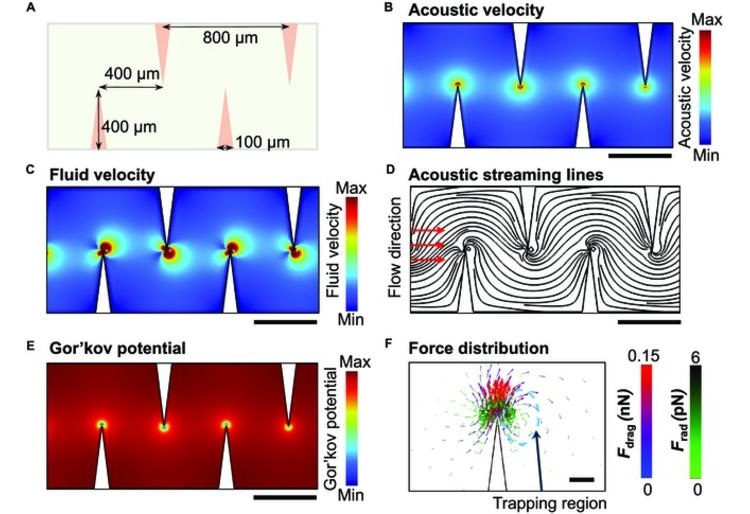
- Dispositivo acustofluídico transforma diagnóstico basado en VEp POC
- Algoritmo de IA evalúa deterioro progresivo de función renal
- Prueba de influenza basada en sabor podría reemplazar hisopos nasales con chicle
- Puritan Medical Products presenta sus innovaciones en AMP2025 en Boston
- Advanced Instruments se fusionó como Nova Biomedical
- Bio-Rad y Biodesix se asocian para desarrollar ensayos de PCR digital de gotas complejos
- Hologic será adquirida por Blackstone y TPG
- Bio-Techne y Oxford Nanopore acelerarán desarrollo de su cartera de productos genéticos
- Lágrimas ofrecen alternativa no invasiva para diagnósticar enfermedades neurodegenerativas
- Método impulsado por IA combina datos sanguíneos para medir con precisión edad biológica
- Herramienta de IA detecta cáncer en muestras de sangre en 10 minutos
- Análisis patológico con IA ofrece diagnóstico integral del cáncer
- IA mejora detección del cáncer cervical en entornos de bajos recursos

 Expo
Expo
- Espectroscopia Raman portátil ofrece diagnóstico rentable de enfermedad renal en POC
- Nanopartículas de oro mejoran precisión del diagnóstico de cáncer ovárico
- Tecnología de aislamiento celular simultáneo mejora precisión del diagnóstico del cáncer
- Sencilla prueba capilar no invasiva podría acelerar diagnóstico de ELA
- Prueba de saliva detecta niveles elevados de ácido úrico sin necesidad de extraer sangre
- Pruebas genómicas podrían reducir biopsias de ganglios linfáticos en pacientes con melanoma
- Análisis de orina podría reemplazar dolorosas biopsias renales para pacientes con lupus
- Análisis de sangre guían inmunoterapia postquirúrgica para cáncer de vejiga músculo-invasivo
- Mutaciones del ADN mitocondrial derivadas de factores de estrés renal podrían predecir deterioro del órgano
- Análisis sanguíneo podría predecir resultados de cirugía bariátrica en adolescentes
- Pruebas viscoelásticas podrían mejorar tratamiento de hemorragia materna
- Modelo mide exposición a radiación en sangre para tratamientos precisos contra cáncer
- Las plaquetas podrían mejorar detección temprana y mínimamente invasiva del cáncer
- Dispositivo portátil desechable obtiene plasma rico en plaquetas sin equipos complejos
- Prueba de cartucho desechable ofrece resultados de hemograma rápidos y precisos
- Genes característicos predicen expansión de células T en inmunoterapia
- Diagnóstico por microscopio molecular evalúa rechazo del trasplante de pulmón
- Análisis sanguíneo detecta resistencia al tratamiento en cáncer ovárico seroso de alto grado
- Sonda luminiscente mide actividad de células inmunitarias en tiempo real
- Firmas de células inmunitarias en sangre guían tratamiento para pacientes graves
- Dispositivo de diagnóstico rápido de sepsis para atención crítica personalizada a pacientes de UCI
- Plataforma microfluídica evalúa función de neutrófilos en pacientes con sepsis
- Nuevo método diagnóstico confirma sepsis de forma más temprana
- Nuevos marcadores podrían predecir riesgo de infección grave por clamidia
- Espectroscopia portátil detecta de forma rápida y no invasiva bacterias en fluido vaginal
- Plataforma GPU integrada permite análisis rápido de sangre para diagnósticos en POC
- Prueba de biosensor viral detecta simultáneamente hepatitis y VIH
- Dispositivo acustofluídico transforma diagnóstico basado en VEp POC
- Algoritmo de IA evalúa deterioro progresivo de función renal
- Prueba de influenza basada en sabor podría reemplazar hisopos nasales con chicle
- Puritan Medical Products presenta sus innovaciones en AMP2025 en Boston
- Advanced Instruments se fusionó como Nova Biomedical
- Bio-Rad y Biodesix se asocian para desarrollar ensayos de PCR digital de gotas complejos
- Hologic será adquirida por Blackstone y TPG
- Bio-Techne y Oxford Nanopore acelerarán desarrollo de su cartera de productos genéticos
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Lágrimas ofrecen alternativa no invasiva para diagnósticar enfermedades neurodegenerativas
- Método impulsado por IA combina datos sanguíneos para medir con precisión edad biológica
- Herramienta de IA detecta cáncer en muestras de sangre en 10 minutos
- Análisis patológico con IA ofrece diagnóstico integral del cáncer
- IA mejora detección del cáncer cervical en entornos de bajos recursos











 assay.jpg)